【学科知识】Alevel化学之AS阶段Physical Chemistry知识点汇总!
2021-04-07 环球教育
Alevel化学是国内孩子读Alevel常选科目之一,且为大学学习化学石油化工、生物化学、制药、食品、生命科学等专业的必选学科。
Alevel化学包含Physical Chemistry、Inorganic Chemistry、Organic Chemistry三部分,今天我们主要聊一聊AS阶段Physical Chemistry的知识点。
Chemical formulae and moles
原子和分子即轻又小,大小约为1*10(-9)m,质量约为1*10(-22)g。
相对原子质量(relative atomic mass)和相对分子质量(relative molecular mass)由碳12的质量的1/12定义。
Mole:一摩尔的物质包含6.022*12(23)个粒子。这里的粒子包括原子,分子电子等等,需要具体分析。
Empirical formula 一种化合物的实验化学式是最简单形式的化学式,只显示包含的原子的数量比。
Molucualr formula 一种化合物的分子化学式显示所包含的所有原子的数量。
化学反应中质量不发生变化,参与反应的原子总数也不发生变化。
化学方程反应:平衡态下,反应前后的每一种元素的原子数量相同。
计算摩尔量的公式如下:

Atomic structure
Atom 所有原子都由三种亚原子粒子(subatomic particles)组成:电子,原子,中子。他们的相对电荷数为-1,+1,0。他们的质量(相对于质子)是,1/1836,1,1。
Proton number 原子的质子数(原子数)为原子核内所含的质子的数量。这也是元素周期表的排布顺序。
Isotope 同位素是质子数相同但是中子数不同的相同元素。
Mass number 一个原子的质量数是其中子和质子数量的总和。
原子的完整符号以其质量数为上角标,原子数为下角标。
Mass spectrometer 质谱仪可以用于测量同位素的质量以及丰富度。
Chemical energy 化学能由两部分组成:粒子的动能(Kinetic energy)和静电力带来的势能(Potential energy)。
Orbital 电子会围绕原子核被分布在不同的能量级上,也就是轨道。
当一个电子由高能级移到低能级时,量子能量就会以光子的形式释放出来(有时肉眼可见,但多数时候是紫外线)
在第n层电子壳上有
第二层电子壳上有1个 s 轨道和3个 p 轨道,第三次电子壳上有1个 s 轨道,3个 p 和5 个
d 轨道。
原子上的电子会先填满能量更低的轨道。
一个原子连续的离子能,以及第一离子能在元素周期表里面的变化规律,都可以给我们电子以电子排布的信息。
Chemical bonding in simple molecules
Chemical bonding 化学键的形成是因为一个原子的电子对另一原子原子核的吸引。
原子在成键时比自由态下更加稳定。
Covalent bond 共价键是有一两个原子共用同一对电子。
一个原子在他的价电子层(valence shell)上有多少电子就可以形成多少键。第二周期元素例外,价电子层上不能多于8个原子。
Lone pair 不成键的价电子层电子会形成原子周围的孤电子对。
Dative bonding(coordinate bonding) 配位键出现在成键原子提供全部的成键电子。
双键和三键出现在两个原子同时共用两对或三对电子时。
共价化合物的形状由中心原子的价电子层电子数决定(VSEPR理论)。
Dipole 如果两个成键原子电负性不同,那么共用的电子对会倾向于电负性更高的原子——这会造成化学键的极性。
Dipole moment 如果所含化学键的极性无法相互抵消,完整的原子会有极性矩。
Isoelectronic 等电子原子或粒子一般会有相同的形状。
Intermolucular forces 有三种分子间作用力:固有偶极,感生偶极,氢键,力的大小依次增加。
Solids,liquids and gases
固体,液体和气体主要的区别在于粒子有没有相互接触,有没有固定为位置还是移动状态。
Crystall 晶体固体由晶格(lattice)组成,晶格又分为简单分子(simple molecular),大分子(macromolecular),金属(metallic)或离子(ionic)晶格。其最重要的物理性质取决于是哪种晶格。
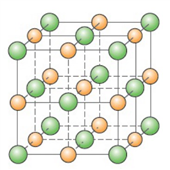
Simple molecular lattice 低熔点,无论哪种情况下都是电绝缘体(electrical insulator)。
Macromolecular lattice 高熔点,无论哪种情况下都是电绝缘体。
Ionic compound 离子化合物由金属阳离子和非金属阴离子组成。
Ionic lattice 高熔点,脆性,只在熔融或者溶液状态下导电。
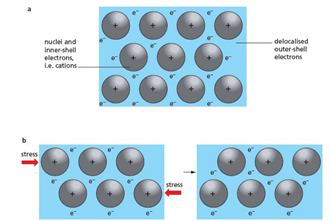
金属和石墨导电是因为有自由电子(delocalised)。
Metallic lattice 金属晶格有延展性,韧性,相对比较高的熔点。
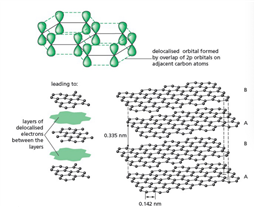
Graphite 石墨是一种各向异性(anisotropic)材料,由于他们晶格分层的特性。
Ideal gas equation 理想气体方程,pV=nRT(R,gas constant)。
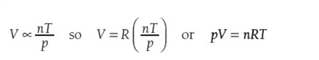
尽管真实的气体的表现近似于理想气体,在低温和高压下,真实的气体很难表现出理想状态。
Energy changes in chemistry
Enthalpy change of a reaction 反应的焓变是反应物到产品的焓的变化
Enthalpy change of solution 溶解的焓变是一种物质完全溶解在水里的焓的变化。
焓变可以直接通过量热仪(calorcalorimeter)进行测量。其他都可以通过公式进行计算

这里的m是水的质量(g),c是水的热容积,
焓的变化可以由公式进行计算
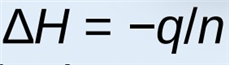
这里n是反应物的摩尔量或者产物的摩尔量。
放热反应(exothermic reaction)△
吸热反应(endothermic reaction)
海斯定律(Hess’s Law)表示反应的
气相中发生的反应熵变相等于被破坏的化学键的键能总和减去形成的化学键键能总和。
Enthalpy changes of atomisation 可以用于计算键能。
Standard conditions 标准环境是 1 atm压强以及特定温度(通常为298K)下的环境。
Standard enthalphy change of reaction,标准反应熵变
想要学好化学的同学就要吃透这些知识点,今天先跟各位同学分享这5个知识点,要记得多看两遍研究复习,我们下期再继续。
环球优思国际教育课程辅导
全面开班
数学/物理/化学/经济/生物
心理/商务/会计/计算机
IGCSE/A-Level辅导

北京市海淀区环球雅思培训学校 版权所有 课程咨询热线:400-616-8800
Copyright 1997 – 2026 gedu.org. All Rights Reserved 京ICP备10036718号
全部课程、服务及教材面向18岁以上人群
市场合作申请